细胞培养的小肠粘膜有助于了解先天免疫保护免受食物感染。
肠上皮概述了口服摄入的微生物和私人自身间隙环境之间的界面。 小肠上皮细胞通过跨膜模式识别受体能够识别微生物配体(1)(2)(3)在防御病原微生物中发挥关键作用。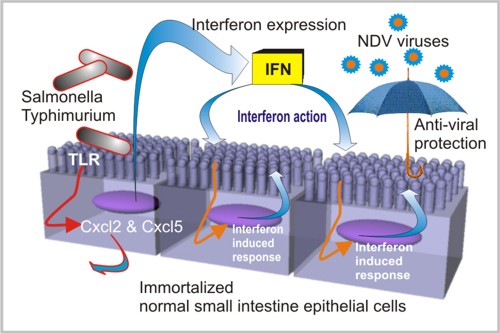

现在,这种非自我认识的功能结果被毫无定义,并且由该保护性鉴定启动的信号传导途径,效应物和调节机制尚未完全理解。
**近,德GBraunschweig(德G)的Helmholtz感染研究中心的基因调控和分化系的研究小组发表了一篇文章,介绍了基于小肠成熟细胞的细胞培养的新数据(4)。
本文介绍了详细参考以前的出版物(5)并通过SV40大T抗原(TAg),Krüppel样因子4(Klf4)的慢病毒转导永生化的从小鼠E19.5胎儿获得小肠上皮细胞的有效方法。和DNA结合抑制剂3(Id3)。 在该转导后约两个月,细胞显示出无限增殖的无限增殖性状,没有衰老迹象超过一年,长方体形状,接触依赖性生长抑制和细胞单层形成。 这些细胞可以通过有限稀释进行冷冻解冻和亚克隆,表现为显示肠上皮表型标记的真正永生化细胞系,例如膜结合连接闭塞蛋白(ZO)-1(6),基底外侧组织粘附E-钙粘蛋白(7),间隙连接蛋白连接蛋白43(8),中间丝蛋白波形蛋白,NADPH氧化酶4(Nox4)和三个刷边界酶,其支持吸收上皮的代谢功能:二肽基肽酶4 ),蔗糖异麦芽糖酶(ISI)和氨基肽酶N(APN),所有这些都已知由肠上皮细胞表达。 重要的是,当这些细胞在反式孔插入物中培养时,它们显示跨上皮电阻,指示在单层(9)的两侧之间形成紧密屏障的能力(提供肠内内腔和下面的组织)。
使用这种小肠粘膜的体外模型,作者显示在存在覆盖上皮细胞单层的介质中稀释的各种先天免疫配体(Toll样受体(TLR)4和5配体,脂多糖(LPS)和鞭毛蛋白)所述细胞以表达Cxcl2和Cxcl5的剂量依赖性方式反应。
他们还使用相同的方法来获得小肠IFN报道子上皮细胞,现在来自转基因小鼠,旨在研究这些细胞单层对IFN的反应,以增强对病毒感染的保护。 用相同的永生化方案处理的这些细胞类似地作出反应,并提供通过表达萤光素酶作为对INF刺激的细胞反应的报告物响应INF I和III的小肠粘膜的体外模型(IEC-Mx2Luc-10细胞) 10)。为了测试抗病毒保护,使用新城疫病毒(NDV)。 干扰素预处理的单层细胞培养物暴露24小时**80个血细胞凝集单位/ ml NDV。 通过NDV血凝素 - 神经氨酸酶(HN)细胞表达的流式细胞术分析对感染水平进行定量,显示病毒在INF预处理的IECMx2Luc-10细胞中不复制,但在未处理的细胞中确认,证明可以诱导保护性抗病毒条件在用IFN预处理后的IEC-Mx2Luc-10细胞中。 此外,用鼠伤寒沙门氏菌(11)感染的IEC-Mx2Luc-10细胞也能够产生IFN。 这些实验与来自细菌感染的IECMx2Luc-10细胞培养物的条件培养基与未感染的IECMx2Luc-10细胞培养物的混合的交叉测试一起显示了小肠粘膜的这种体外复制物的完全抗病毒保护性质及其用于进一步研究小肠上皮细胞的先天免疫保护作用。






